
研究プロジェクト
- JST未来社会創造事業「世界一の安全・安心社会の実現」領域・重点公募テーマ「ヒューメインなサービスインダストリーの創出」:平成29年度~「半導体バイオセンサ技術によるヘルスモニタリングサービスの実現」-研究代表者
- AMED「医療分野研究成果展開事業(先端計測分析技術・機器開発プログラム)」:平成30年度~「モチベーション喚起型血糖コントロール指標測定デバイスの研究開発」-研究分担者
- 科学技術研究費補助金 基盤研究(B):平成30年度~「体外受精卵の成長をモニタリングするリング型マルチ卵重計の創製」:研究分担者
- NEDO研究開発型ベンチャー支援事業:平成27~28年度「涙液体外診断薬・臨床検査プラットフォームの開発」-研究分担者
- ImPACTセレンディピティの計画的創出:平成27年度「高速エレクトロフローサイトメーターの研究開発」:チームリーダー (PM合田圭介プログラム・マネージャー)
- 科学技術研究費補助金 基盤研究(B):平成26~28年度「体外受精卵のクオリティーを選別するマルチ卵重計の創製」:研究分担者
- 文部科学省 大学発新産業創出拠点プロジェクト(プロジェクト支援型) 平成24年度~平成26年度「非侵襲型診断医療に向けた半導体バイオセンシングの実用開発研究-採血フリーグルコースセンサによる糖尿病患者の負担軽減を目指して-」- 代表者
- (独)科学技術振興機構 先端計測分析技術・機器開発事業 要素技術 平成20年度~平成23年度「半導体バイオセンシング技術による1チップゲノム解析」- 代表者
- (独)科学技術振興機構 CRESTタイプ 平成20年度~平成25年度「機能化ナノ構造ゲートバイオトランジスタの創製」- 分担者
- 科学技術研究費補助金(若手A) 平成20年度~平成22年度「電界効果を基本原理とした細胞膜電荷分布ナノイメージング技術の創製」- 代表者
- 財団法人村田学術振興財団 研究助成 平成19年度「シリコンベースバイオトランジスタによる受精・胚分割過程の非侵襲電気的モニタリングと生殖補助医療応用への基礎検討」- 代表者
- 財団法人医科学応用研究財団 研究助成 平成19年度「半導体バイオトランジスタによる創薬スクリーニングデバイスの研究開発」- 代表者
- 東京大学ナノバイオ・インテグレーション研究拠点 平成18年度~平成21年度「生体分子認識・細胞機能解析デバイスにおけるバイオセンシング技術の開発」- 分担者
- 学技術研究費補助金(若手B) 平成17年度~平成19年度「ナノ帯電粒子-DNA複合体を用いた遺伝子トランジスタによる高感度遺伝子多型解析」- 代表者
科学技術研究費補助金(若手A) 平成20年度~平成22年度 「電界効果を基本原理とした細胞膜電荷分布ナノイメージング技術の創製」
本課題では、生体を構成する最小単位である細胞の機能をin vitroで簡便に解析し、診断や薬剤などのスクリーニングのツールとして発展可能な技術をエレクトロニクスとの融合領域から研究開発する。平成20年度は、細胞をシャーレなどの培養皿に播種し、基材と接着していない細胞膜における電荷分布をイメージングする手法について検討した。その方法として、原子間力顕微鏡(Atomic Force Microscopy; AFM)の動作原理を利用した。AFMで使用されるカンチレバーを準備し、そのレバー部の先端にnmサイズの微小な針を形成する。本年度は、針部に導電性の白金をゲート電極として作製することに成功した。針部以外の表面は絶縁膜としてSi3N4でコーティングすることにより、測定中の溶液との接触を針部の白金とのみ実現し細胞膜表面の電荷を高精度に計測可能になると考えられる。測定系にはExtended-gate型バイオトランジスタの原理を利用する。バイオトランジスタはシリコンデバイスに形成された薄いゲート絶縁膜上で起きる生体分子認識反応の電荷密度変化を検出するのに対し、Extended-gate型ではゲート部をトランジスタ本体から伸張しゲート表面での生体分子認識反応に基づく電位変化をトランジスタにより検出する構造をしている。そのため、ゲート部の材料を必要に応じて選択でき、センサーの繰返し使用を考えた場合、トランジスタは再利用しゲート部のみの交換となるためコストを低減することができる。特に本課題においては、センシング部となるカンチレバー(以後ゲートレバー)をトランジスタ本体から分離して作製できるため微小走査部の作製が容易となる。本年度は、以上の作製したゲートレバーを用いることにより細胞膜表面の負電荷を検出することに成功し、その動作原理を確認した。
財団法人村田学術振興財団 研究助成 平成19年度 「シリコンベースバイオトランジスタによる受精・胚分割過程の非侵襲電気的モニタリングと生殖補助医療応用への基礎検討」
〔概要〕
本課題では、シリコンをベースとした半導体バイオトランジスタにより、受精・胚分割過程を非侵襲でモニタリング可能であることを明らかにした。これにより、人工授精で得られた受精卵の胚活性を非侵襲で検出することが可能となり、簡便で高精度の良好胚の選別を実現し生殖補助医療技術への展開が期待される。本課題では、ヒトを含め哺乳動物における受精実験を実施する前に、動物実験における倫理的問題を考慮しウニなどの無脊椎動物における予備実験から実施した。受精・胚分割を非侵襲モニタリングする場合、未受精卵から精子との先体反応を介した受精により、卵分割が急激に進行し同時に受精卵として活動を開始し呼吸量の増加があると考えられる。すなわち、呼吸によって排出されるCO2により受精卵/バイオトランジスタ界面におけるpH変化、つまりH+量が変化し電界効果によりモニタリング可能であることが本実験よりわかった。バイオトランジスタのゲート材料として使用しているSi3N4やTa2O5表面は、水溶液下でシラノール基(Si-OH)を有すためH+に対する感受性が高く、バイオトランジスタはpHセンサーとしても利用可能である。そのため、本課題の受精卵の呼吸にともなうpH変化を検出するのにバイオトランジスタは最も有効な計測法であったと考えている。
〔本文〕
(緒言) 生殖補助医療技術(Assisted Reproductive Technology; ART)が不妊症の治療に導入されるようになり、同時に産婦人科医以外の技術者の役割が重要となってきている。ARTでは体外受精-胚移植を実施する上で、いかにして良好胚を選択するかが最も重要な決定因子となる。良好な胚移植の選択には、短時間でかつ非侵襲で実施される必要があるため、割球の均一性やフラグメンテーションの割合を基にした顕微鏡下での形態学的特徴により判断することが一般的である。しかしながら、それらの選択法におけるその後の着床率および妊娠率に対する効果については十分な確証が得られておらず、新たな評価法の提案が望まれている。また、不妊治療のためのARTにおいて、二絨毛膜性双胎や血液キメラなどのリスクがあることから多胎妊娠はARTにおける重大な合併症のひとつとして認識されてきており、北欧諸国においてはいち早く多胎妊娠を回避するためeSET (Elective single embryo transfer:選択的単胚移植) が行なわれている。国内においては、従来は妊娠率の向上のため一回の移植に2つの受精卵を移植するケースが多かったが、2007年に日本生殖医学会「多胎妊娠防止のための胚移植数ガイドライン」が制定されるなど、近年、急速にeSET を施行する医院が増えている。eSETの実施にあたり最も重要なことは、得られた受精卵の中から最も発生能の高い胚を選択することである。現状では形態学的観察による評価方法が一般的に用いられているため、定量的・客観的な評価方法の提案が切望されている。 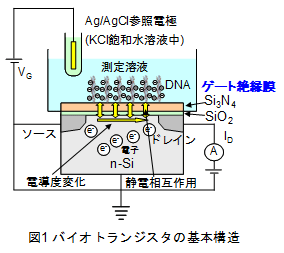 一方、これまでに我々の研究グループでは、Siを基板としたバイオトランジスタにより、遺伝子あるいは細胞の機能を分子固有の電荷変化として電界効果の基本原理に基づき電気的に検出することに成功している。図1の模式図に示すように、バイオトランジスタはSi(n型あるいはp型)をベースに厚さ10nm~100nm程度のSiO2/Si3N4をゲート絶縁膜とした構造である。測定原理として、ゲート絶縁膜表面を測定溶液に浸漬し、ゲート電位(VG)は測定溶液に挿入されたAg/AgCl参照電極により制御されている。例えば、ゲート絶縁膜表面にDNAのような水溶液中で負電荷を有する分子が吸着すると、これらの分子の電荷とSi中の電子が薄い絶縁膜を挟んで静電的に相互作用する。その結果、Si表面のチャネル部での電子密度が変化、すなわちドレイン電流(ID)が変化するため、ゲート絶縁膜表面での電荷を有する分子の吸着を電気的に検出することができる。この原理を用いて我々の研究グループでは、ハイブリダイゼーションのみならずインターカレーション、DNA伸張反応といった種々のDNA分子認識反応を検出することに成功しており、さらに各反応で生じる分子固有の電荷変化に基づいて一塩基多型(Single Nucleotide Polymorphism; SNP)タイピングや一塩基ごとに配列を読んでいくDNAシーケンシングが可能であることを世界で初めて実証している。
一方、これまでに我々の研究グループでは、Siを基板としたバイオトランジスタにより、遺伝子あるいは細胞の機能を分子固有の電荷変化として電界効果の基本原理に基づき電気的に検出することに成功している。図1の模式図に示すように、バイオトランジスタはSi(n型あるいはp型)をベースに厚さ10nm~100nm程度のSiO2/Si3N4をゲート絶縁膜とした構造である。測定原理として、ゲート絶縁膜表面を測定溶液に浸漬し、ゲート電位(VG)は測定溶液に挿入されたAg/AgCl参照電極により制御されている。例えば、ゲート絶縁膜表面にDNAのような水溶液中で負電荷を有する分子が吸着すると、これらの分子の電荷とSi中の電子が薄い絶縁膜を挟んで静電的に相互作用する。その結果、Si表面のチャネル部での電子密度が変化、すなわちドレイン電流(ID)が変化するため、ゲート絶縁膜表面での電荷を有する分子の吸着を電気的に検出することができる。この原理を用いて我々の研究グループでは、ハイブリダイゼーションのみならずインターカレーション、DNA伸張反応といった種々のDNA分子認識反応を検出することに成功しており、さらに各反応で生じる分子固有の電荷変化に基づいて一塩基多型(Single Nucleotide Polymorphism; SNP)タイピングや一塩基ごとに配列を読んでいくDNAシーケンシングが可能であることを世界で初めて実証している。
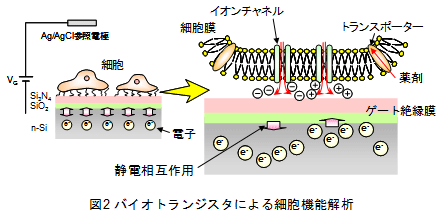
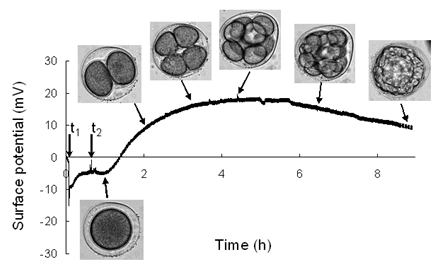
さらに、細胞膜機能解析では、図2の模式図に示すように、細胞膜に特異的に点在するトランスポーターでの薬剤の取込を、同時に誘起されるイオンチャネルといった膜タンパク質から流出するイオンの電荷変化としてバイオトランジスタにより電気的に検出することに成功しており、細胞膜で生じる諸現象を直接電気シグナルで検出可能であることを実証している。以上のことから、本原理を用いることにより分子固有の電荷を検出できるため、(1)非標識での検出が可能、(2)細胞膜および細胞膜/ゲート絶縁膜界面での電荷変化を非侵襲で直接モニタリング可能、といった利点が挙げられ、さらに、(3)従来の半導体加工技術を利用すると一つの小型チップの上に複数の検出部をアレイ化し並列解析が可能、(4)測定回路を組み込んだ安価な測定系を実現できるため光学系など高価な装置を必要としない、といった測定系の小型化・低コスト化にも大きな貢献が期待される。 以上の実状を背景に、バイオトランジスタの利点である“細胞膜および細胞膜/ゲート絶縁膜界面での電荷変化を非侵襲で直接モニタリング可能”が、ARTで求められている“良好な胚移植の選択には短時間でかつ非侵襲で実施される必要がある”という課題を克服するのに最適なエンジニアリングであると期待される。さらに、安価な測定系で複数個の検体を簡便に並列的に自動解析可能であることから、コストの低減および高スループット化も大いに期待される。 本課題では、発生実験で広く一般的に利用される棘皮動物のウニから採取した卵子および精子を用いて、その受精・胚分割過程における電気特性についてバイオトランジスタにより調査し、バイオトランジスタがヒトを対象としたARTにおける良好胚選択の手法になり得るかについて検討した。 (実験方法) 北海道厚岸、神奈川県三崎より採取したウニを用い、0.5M KClを注入することにより採卵した。バイオトランジスタの電気特性の評価には半導体パラメーターアナライザーおよびリアルタイムFET測定装置を用いた。測定溶液および卵細胞の添加溶液に人口海水を使用し、卵細胞、精子添加およびその後の卵割に伴うゲート絶縁膜の表面電位の時間変化を調査した。 (実験結果) 図3にバイオトランジスタによる受精、卵割過程の電気特性変化を示す。縦軸はゲート絶縁膜表面の電位(電荷量)、横軸には時間を示す。最初に、ゲート絶縁膜上に未受精の卵子を添加したところ(t1)、表面電位が急激に減少することが明らかとなった。これは、ウニ卵子表面のジェリー層に含まれるシアル酸や硫酸化多糖といった負電荷のゲート絶縁膜表面への接着によるものと考えられる。さらに、未受精卵に精子を添加したところ(t2)、受精膜の形成による受精の確認の後、バイオトランジスタの表面電位が上昇していくのが観察された。この表面電位の上昇は、受精による卵割の開始とともに卵子の活性に変化が生じたものと考えられる。つまり、未受精卵に比べ受精卵は卵割と同時に呼吸量が増加し、受精卵外に排出されるCO2量が受精卵/ゲート絶縁膜界面において上昇し、結果的にその界面においてpH変化、つまり正電荷を有するH+量の増加に伴って、表面電位が上昇したものと考えられる。さらに、8細胞期を過ぎたあたりから表面電位が一定あるいは減少する様子が観察された。これは、8細胞期まではそれぞれの割球が同調して分割していくのに対して、8細胞期以降は個々の割球が不規則に分割していくために、受精卵全体からするとみかけ上活性が定常状態あるいは低下したように考えられる。つまり、受精卵/ゲート絶縁膜界面ではH+イオンは増加せず、むしろ8細胞期までにpH変化に関与したH+の拡散が生じて表面電位が低下したと考えられる。以上のように、バイオトランジスタによりウニ受精卵の活性を非侵襲で簡便にモニター可能であることが明らかとなり、その指標として、呼吸に伴うH+変化を利用し、受精卵の分割過程における状態を評価可能であると考えられる。つまり、本課題によりバイオトランジスタによるヒトなどの哺乳動物における受精卵の活性評価の指針を得ることができた。
科学技術研究費補助金(若手B) 平成17年度~平成19年度 「ナノ帯電粒子-DNA複合体を用いた遺伝子トランジスタによる高感度遺伝子多型解析
これまで、電界効果トランジスタ(Field Effect Transistor; FET)を用いた電位計測方式による新規遺伝子解析技術として遺伝子トランジスタ(遺伝子FET)を提案し、センシング部となるゲート絶縁膜上での種々のDNA分子認識の検出に成功してきた。さらに本課題では遺伝子FETの高感度化を目指して、特に平成17年度ではより多くの電荷を帯電させたナノ帯電粒子-DNA複合体に対する遺伝子FETの電気特性変化について調査した。まず、ナノ粒子に直径5~20 nmの金を使用し、DNAには末端をチオール基修飾したオリゴヌクレオチドを用いてナノ粒子-DNA複合体を作製した。チオール分子を末端に化学修飾したオリゴヌクレオチドは金表面に容易に自己組織化膜を形成すると同時に、DNAは水溶液中で負電荷を有することから、金ナノ粒子を使用することで帯電したナノ粒子-DNA複合体を容易に作製することが可能となった。このように作製した金ナノ粒子-DNA複合体を遺伝子FETのゲート表面に導入し、サンドイッチアッセイ法によりゲート表面でハイブリダイズさせた結果、80 mV程度の遺伝子FETの電位応答が確認され、通常のハイブリダイゼーション検出における20 mV程度の電位変化と比較すると4倍程度増加することが明らかとなった。これはナノ粒子とDNAを組み合わせることにより、大きな電荷を有するナノ粒子-DNA複合体が形成されるためと考えられる。以上のことから、ナノ帯電粒子-DNA複合体を用いることにより遺伝子FETのシグナル増幅が期待され高感度化の可能性が見出された。 平成18年度は、ターゲットDNAの濃度を変化させ高感度化の効果を調査し、ナノ帯電粒子-DNA複合体導入による一塩基多型(Single Nucleotide Polymorphism, SNP)検出のプロトコルを確立した。まず、ターゲットDNAの濃度を100aM、100pM、100μMと変化させ各サンプルをハイブリダイゼーション後、複合体を導入しその前後の電気特性変化を調べた。その結果、ターゲットDNA濃度が100aMという低濃度でも複合体の導入によりしきい値電圧(VT)が12mV変化することが明らかとなった。この結果は通常のハイブリダイゼーションによるVT変化の5倍程度大きく、複合体導入による低濃度サンプルの検出が可能となった。さらに本課題のSNP検出ではライゲーションアッセイ法を利用する。ライゲーションアッセイ法ではサンドイッチアッセイによリターゲットDNAとハイブリダイゼーションしたDNAプローブと複合体DNA(レポーターDNA)をリガーゼ酵素により連結(ライゲーション)する。その際DNAプローブはライゲーションする末端がSNPサイトとなるように設計する。末端のSNPサイトがターゲットDNAと相補的である場合は酵素反応によりレポーターDNAがDNAプローブとライゲーションされ複合体はゲート表面上に残る。そのためライゲーション反応後ターゲットDNAを解離するとゲート表面に複合体が固定されたまま残る。一方末端のSNPサイトがターゲットDNAと非相補的である場合はライゲーション反応が起きないためターゲットDNAが解離される際に同時に複合体もゲート表面から取り除かる。このようにライゲーション反応の有無による複合体の電荷密度変化をVT変化として捉えることにより高感度のSNPタイピングが可能となる。平成18年度は以上の一連のプロトコルがゲート絶縁膜表面で可能であることを確認した。 平成19年度は、平成18年度に実施したナノ帯電粒子の利用によるDNA検出の再現性を調査し精度の高いDNAハイブリダイゼーションの検出が可能であることがわかった。さらに、ナノ帯電粒子-DNA複合体を組み合わせた遺伝子トランジスタによる一塩基多型(Single Nucleotide Polymorphism, SNP)検出にライゲーションアッセイ法を利用する実験手法を確立した。ライゲーションアッセイ法では、サンドイッチアッセイによリターゲットDNAとハイブリダイゼーションしたDNAプローブと複合体DNA(レポーターDNA)をリガーゼ酵素により連結(ライゲーション)する。その際、DNAプローブは、ライゲーションする末端がSNPサイトとなるようにあらかじめ設計する必要がある。末端のSNPサイトがターゲットDNAと相補的である場合は、酵素反応によりレポーターDNAがDNAプローブとライゲーションされナノ帯電粒子-DNA複合体はゲート表面上に残る。そのため、ライゲーション反応後ターゲットDNAを解離するとゲート表面にナノ帯電粒子-DNA複合体が固定されたまま残る。一方、末端のSNPサイトがターゲットDNAと非相補的である場合は、ライゲーション反応が起きないため、ターゲットDNAが解離される際に同時にナノ帯電粒子-DNA複合体もゲート表面から取り除かる。このようにライゲーション反応の有無によるナノ帯電粒子-DNA複合体の電荷密度変化を半導体パラメーターアナライザー(4155C, Agilent)を用いてしきい値電圧(VT)の変化として捉えることが可能となり、高感度のSNPタイピングの可能性が得られた。



