
研究テーマ紹介
近年、医学、薬学、工学など様々な学問分野が異分野融合し、これまで以上に自然科学の解明や医療に関する臨床現場での技術の発展が進んでいます。その中で、高齢化社会にある今、循環器系の疾患やがん、アルツハイマー、骨粗鬆症といった様々な病気で苦しむ患者が増加し、QOL(Quality Of Life)向上のための方策が必要とされています。特に、それぞれの疾病を治療する医療現場での技術、新薬の開発、さらには診断技術における新原理の創出やその高精度化が重要となり、工学的立場から医学、生物学への寄与が増加し、その中でも診断技術では生体を害することなく診断可能な非標識、非侵襲で簡便な計測技術が要求されています。生体の機能は、細胞ではイオンチャネルからのイオンの出入りが細胞間コミュニケーションを担い、細胞内にあるDNA分子は側鎖にイオン性のリン酸基があります。つまり、生体の機能を直接計測するには、イオンやイオン性分子を簡便に捉えることが重要と考えられます。我々の研究室では、半導体バイオセンシング技術の基本原理である電界効果を利用したセンシング技術により、DNA、タンパク質、細胞などの生体機能をそれぞれ固有の電荷の振る舞いとして捉え、生体機能/シグナル変換界面/半導体といったデバイス3要素に注目し、半導体デバイスの創製、生体機能/半導体デバイス界面の機能化および界面現象の理解、半導体デバイス表面で計測する生体機能のデザインおよびその挙動制御、といった一連のデバイス創製に関する諸課題に取り組んでいます。対象となる生体機能として、薬効に関連する細胞死アポトーシス、循環器疾患に関連する血管内皮細胞の挙動、生殖補助医療に向けた体外受精における生体外での胚活性、骨再生、ES細胞やiPS細胞の分化挙動、細胞膜トランスポーターにおける物質輸送などが挙げられ、DNA分子認識では現状の次世代高速DNAシーケンサーを上回る性能をもったラベルフリー・リアルタイムDNAシーケンシング技術の開発を目指しています。特に、疾患の診断・薬効にも注目しin vitroで各部位を正確に模擬しモニタリングすることでラベルフリー、非侵襲で計測可能な診断・オーダーメード医療デバイス、創薬スクリーニングデバイス、DNAシーケンサーへの応用を視野に入れ、同時に生体機能を総合的に理解することを目指しています。“生命現象の新たな発見には新しい方法論が伴う”新しい方法論の創出と生命現象の理解・解明が我々のバイオセンシング技術探求のモチベーションになっています。
主な研究テーマ
バイオセンシング技術は、様々な生体関連物質やその認識反応を計測するバイオセンサからなり、それは大きく「検出デバイス」、「シグナル変換界面」、「ターゲット」の3つの要素から構成されている(図1)。「検出デバイス」は、様々な生体機能に関わる認識反応を検出する計測原理に相当する部分であり、質量、電荷、屈折率、熱量、粘弾性など様々なバイオパラメータを計測できる。「シグナル変換界面」は、生体関連物質の何を、どういった反応を、特異的・選択的に計測できるかを決める要素となる。例えば、同じ1価の正電荷である水素イオンとナトリウムイオンを区別して計測するために、水素イオンは、溶液下における酸化物表面特有の水酸基によりpHに応じた水素イオンとの平衡反応に基づく特異反応を利用する。
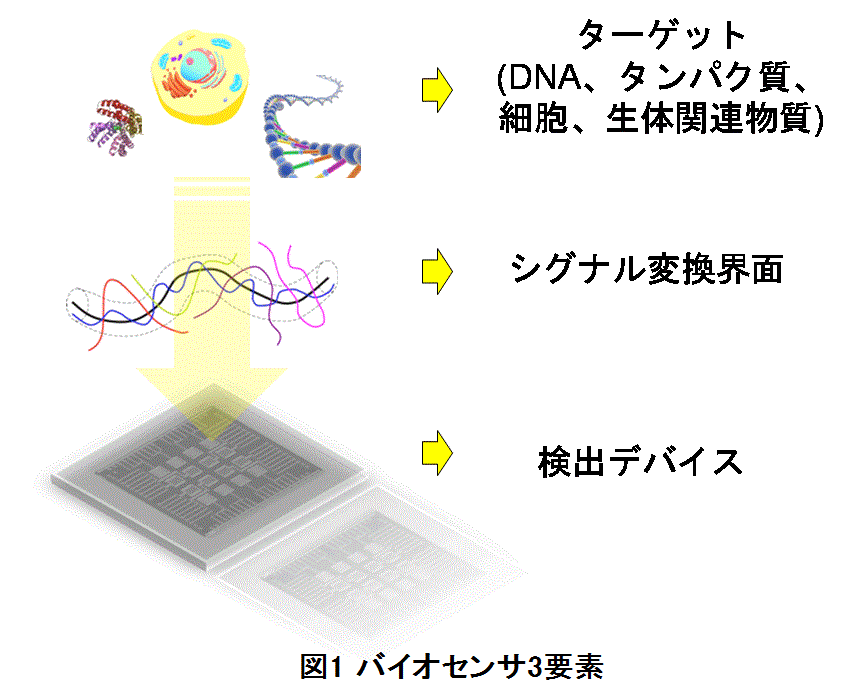
一方、ナトリウムイオンを選択的に捕獲するクラウンエーテルを化学的にセンサ表面に固定化することにより選択性を上げる仕組みを作ることも考えられる。最後に「ターゲット」は、様々な生体機能に対応し、バイオセンサがどういった応用先を狙って設計・作製されたかを最も具体的に示す部分である。すなわち、この応用先が不明確なままデバイス設計がされても元の木阿弥となり、せっかくの高性能デバイスが何にも応用されずにその価値を失うことになる。この3つの要素のどれがかけてもバイオセンサとして十分であると言えない。そのターゲットとなる生体の機能は、細胞ではイオンチャネルからのイオンの出入りが細胞間コミュニケーションを担い、遺伝情報を担うDNA分子は側鎖にイオン性のリン酸基を有している。また、RNAを翻訳することにより得られるタンパク質は電荷などの相互作用によってフォールディングし、固有の立体構造になって機能を有するようになる。このように、生体の機能に関して電荷は非常に大きな役割を果たしており、生体の機能を計測するには、その機能に関わる電荷を直接計測することが素直であると思われる。生体機能に関連した電荷を直接計測できる手段として、我々は電界効果を基本原理とした半導体バイオセンシング技術の研究開発を進めている。この方法の基本構造は電界効果型トランジスタ(Field Effect Transistor; FET)である。界面として絶縁膜、検出デバイスとして半導体を使用しており、ターゲットとなる生体分子は絶縁膜上に吸着させ、絶縁膜により半導体と分離されている。表面に吸着した生体分子の電荷が半導体中の電子と薄い絶縁膜を挟んで静電的に相互作用し、絶縁膜直下の半導体表面の電荷密度を変化させる。この電荷密度変化を読み取ることで生体分子の持つ固有の電荷や、細胞膜から放出されるイオンなどを非標識、非侵襲でリアルタイムに計測できる。
1. 生命の最小単位「細胞」のセンシング
生命の最小単位は「細胞」である。細胞の機能計測は、生命の様々な機能を計測する要素となる。細胞は生きているがゆえに死と背中合わせにある。そのため、細胞の機能計測は、その「生」から「死」を様々な細胞機能の時間スケールに合わせて行わなければならない。すなわち、神経細胞や心筋細胞の活動電位のようにミリ秒の短時間から、iPS細胞などの幹細胞では分化とその安全性の評価に数週間や数か月という長い時間を要する場合もある。このような細胞センシングを実現するためには、非侵襲でリアルタイムの計測が可能で細胞の恒常的な機能を計測できるシステムが必要になるだろう。そのためには、「観て」、「計って」、「育てる」システムの構築が望まれるのと同時に、細胞の恒常的な機能として細胞呼吸を水素イオン濃度で計測可能な半導体原理は、細胞センシングにとってとても魅力的な手法となり得ると考えている。
1.1. 移植前診断に向けたART on a Semiconductor
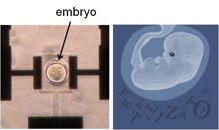
生殖補助医療技術(Assisted Reproductive Technology; ART)が不妊症の治療に導入されるようになり、同時に産婦人科医以外の技術者の役割が重要となってきている。ARTでは体外受精-胚移植を実施する上で、いかにして良好胚を選択するかが最も重要な決定因子となる。良好な胚移植の選択には、短時間でかつ非侵襲で実施される必要があるため、割球の均一性やフラグメンテーションの割合を基にした顕微鏡下での形態学的特徴により判断することが一般的である。しかしながら、それらの選択法におけるその後の着床率および発生率に対する効果については十分な確証が得られておらず、新たな評価法の提案が望まれている。また、着床率の向上を図るため数個の胚を子宮へ移植することがあるが、二絨毛膜性双胎や血液キメラなどのリスクがあることから、多胎妊娠はARTにおける重大な合併症のひとつとして認識されてきており、北欧諸国においてはいち早く多胎妊娠を回避するためeSET(elective Single Embryo Transfer:選択的単胚移植)が行なわれている。国内においては、2007年に日本生殖医学会「多胎妊娠防止のための胚移植数ガイドライン」が制定されるなど、近年、急速にeSET を施行する医院が増えている。eSETの実施にあたり最も重要なことは、得られた受精卵の中から最も発生能の高い胚を選択することである。現状では形態学的観察による評価方法が一般的に用いられているため、同時に行える定量的・客観的な評価方法の提案が望まれており、我々の研究グループでは、非侵襲でリアルタイムに受精卵の呼吸活性を簡便に定量的に計測可能な半導体バイオセンシング技術の応用を検討している。
1.2. アポトーシスセンシングによる副作用・薬効評価
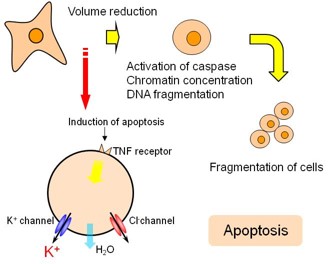
アポトーシスは癌細胞除去の役割を持つ一方、パーキンソン病やアルツハイマー病の原因ともされている。そのため、アポトーシスを阻害する薬や癌細胞のみにアポトーシスを起こす薬などが開発されており、アポトーシス解析は創薬の分野で非常に重要である。従来行われてきた細胞イメージングの手法は、細胞挙動に伴う細胞内物質の生成、移動、相互作用を視覚的に捉える長所を有し、細胞生物学の進展に欠くことのできない技術として発展してきた。だがその一方で、細胞へのダメージが不可避であり、リアルタイムモニタリングが可能な時間、実験系が限られる難点があった。そのため、細胞活動の複雑な相互作用を十分に解き明かすことができず、また多大な時間も必要とした。これに対し、半導体原理による細胞計測は、非侵襲でリアルタイムでの細胞応答のモニタリングが可能であり、従来の手法では得られない細胞機能の情報を与えると考えられる。ここでは、パーキンソン病や癌に深く関係するアポトーシスに注目し、半導体原理によるアポトーシスの非標識・非侵襲リアルタイム計測の可能性について検討している。
1.3. 飢餓適応機構としてのオートファジーの非標識リアルタイムモニタリング
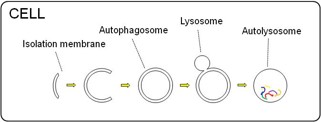
オートファジーは、栄養飢餓状態で起き、細胞内でオートリソソームの形成によりタンパク質からアミノ酸等の栄養分を自ら作りだし生存するプロセスである。栄養飢餓に陥った場合、通常細胞の機能は低下し、細胞死を誘導する結果になると思われるが、我々が行った半導体による計測では、予想とは逆に、呼吸活性が通常の栄養下の培養よりも活発になることが明らかになった。これは、半導体によりpH変化をモニターするという単純なものであるが、細胞周期の制御、培養液交換のタイミング、電気計測と細胞培養が安定して実施可能なシステムなど、諸条件を制御することによりオートファジーの計測に成功した結果である
1.4. 再生軟骨細胞分化挙動の静水圧負荷時in situモニタリング
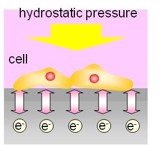
整形外科領域において関節症は患者数が最も多い疾患のひとつである。現在は再生治療として自家軟骨細胞移植法が開発され臨床応用されている。また培養軟骨細胞に静水圧を負荷することで細胞外マトリックス(ECM)の生合成が増加することが水野らの研究によって明らかとなり、これを応用した治療法も臨床応用に近づいている。しかしながら軟骨細胞が分化するメカニズムは不明な点が多く、今後治療をより確実なものとしていくためには分化挙動を計測し、再生軟骨細胞の安全性、妥当性を評価する指標を得る必要がある。一方、近年、診断医療や創薬スクリーニングに向けた様々なバイオセンサの研究開発が進んでおり、その原理も多様化している。なかでも、半導体原理に基づくバイオセンサは、生体機能に深く関わるイオンやイオン性化合物の電荷を非標識、リアルタイム、非侵襲的に計測可能であることから、細胞や生体組織の機能評価に最適な手法であると考えられる。特に、上記の移植に用いる再生軟骨細胞の場合、半導体バイオセンサでは非侵襲的に軟骨細胞の分化に深く関わる代謝活動や硫酸化糖の増加などイオン性物質の電荷挙動を簡便にモニタリングできるものと考える。
2. 半導体/バイオインターフェース構造の制御と理解
生体機能計測における半導体バイオセンシング技術の高感度化・高精度化を実現するには、半導体/バイオインターフェースの工夫、つまり「シグナル変換界面」の役割は重要である。ターゲットとなる細胞や生体分子など生体機能の電気特性をトランジスタに効果的にトランスデュースするか、その界面設計および創製を行う必要がある。そのため以下に示す物理的・化学的・生物学的3つの視点から界面制御(Interfacing)を研究開発している。
a.Physically structured Interface
半導体/バイオインターフェースにおけるゲート表面にナノ構造を配列し物理的に構造制御することにより半導体バイオセンシングデバイスの検出感度の向上を行っている。例えば、Auピラー構造の配列や凹型ナノウェルゲート構造など。(2.1.がその一例)
b.Chemically synthesized Interface
半導体/バイオインターフェースにおけるゲート表面に化学合成した単分子膜や高分子膜を固定化することにより、その機能発現により半導体バイオセンシングデバイスの検出感度や選択性の向上を実現している。(2.2.がその一例)
c. Biologically induced Interface
半導体/バイオインターフェースにおけるゲート表面にシグナル伝達用の細胞を培養し、様々なターゲットに対して、細胞自体がシグナル変換界面材料となる。(2.3.がその一例)
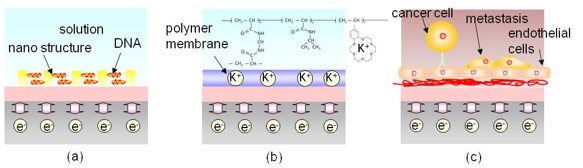
d.上記界面の理解を深めるためには実験的手法では限界がある。そのため、諸条件に合わせたシミュレーション技術により、これまで実験では得られなかった現象を解析し予測することが可能となる。(2.4.がその一例)
2.1. 一分子バイオセンシング
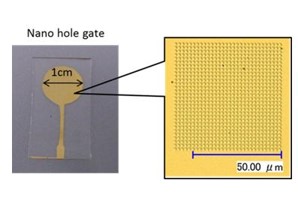
近年、バイオセンシング技術の発展に伴い、生体分子の特異的反応を検出しようと様々な原理を用いたバイオチップの研究開発が行われ、創薬、医学研究、臨床検査といった多岐にわたる分野で活躍している。我々の研究グループは、生体分子固有の電荷に着目し、電界効果を基本原理とした半導体バイオセンシング技術による様々な生態機能計測の可能性について探索しているが、特に、DNA分子固有の電荷を利用することで、非標識でのDNAシーケンスが可能であることを実証している。しかし、バルク溶液中のカウンターイオンによる遮蔽効果により、特にデバイ長を超える長塩基部分の計測が困難などの課題がある。この課題を克服するため、FETのゲート表面にナノスケールの微細な立体構造を施し、デバイ長内でより多くのDNAの電荷を効率的に計測する方法を提案してきた。それを踏まえ現在は、ナノ凹型ゲートトランジスタによるDNAの一分子センシングを目標に、センシング部の表面積を変えたゲート電極を使い、凹型Well状構造の底面積と電気的変化との相関について検討している
2.2. 採血フリーグルコーストランジスタ
現在、世界の糖尿病患者数は4億人程にまで達しており、日本国内においても1000万人程と深刻である。糖尿病患者は日常生活において血糖値のコントロールを行うため、血糖値を自己測定しインスリン注入のタイミングを管理する必要がある。今のところ血糖値の測定にはグルコースオキシダーゼを利用した酵素電極法が広く用いられているが、血液の採取が必要であり侵襲的である、高価な酵素を利用するためコストがかかる、さらにリアルタイムでの継続的なモニタリングには不向きであるといった問題点がある。多くの糖尿病患者は非侵襲的な検査法を求めており、同時に低コストで簡便にリアルタイムモニタリング可能な技術のブレイクスルーが期待される。
2.3. アレルギー診断に向けた半導体原理に基づくバイオセンシング技術
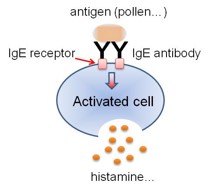
アレルギー疾患は、日本では約2人に1人が罹患し、世界的にも患者数が増加している中で、その発症機構の解明が十分ではなく、患者が望む予防・診断・治療のための諸課題を解決する必要がある。なかでも、アレルギー診断を正確に行うためには、現在、患者から大量の採血を必要とするだけでなく、多項目を診断する必要があるなど長い診断期間を要す。そのため、低侵襲で簡便な評価手法が臨床現場や創薬等の研究現場で求められている。また、簡易診断キットは酵素を用い抗体の有無のみを評価するため正確性に欠けるという課題がある。ここでは、最も身近な食物アレルギーや花粉症などの即時型アレルギーであるⅠ型アレルギーに着目した。特に、アレルギー反応を示す肥満細胞での抗原抗体反応を細胞による化学物質放出・呼吸量変化に対応させ、半導体原理を基盤とした低侵襲・高スループット・高精度な多項目のアレルギー診断が可能なバイオセンサーの創製を目的としている。
2.4. 分子動力学シミュレーションによる半導体/バイオインターフェース構造の解明
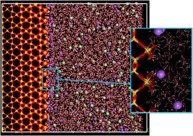
現在、FETバイオセンサはDNA伸長反応や抗原抗体反応などのセンシング、細胞の機能などの解明に応用が進められており、デバイスの正確性、拡張性などの性能改善が求められている。そのためには固相と液相と生体分子からなるバイオインターフェイス構造の理解が必要であるが、現在までのFETバイオセンサにおける溶液構造の議論は生体分子の存在しない状態に限られており、生体分子、固相、液相が一体となったバイオインターフェイスとしての理解は進んでいない。またバイオインターフェイス構造を実験により明らかにすることは非常に困難である。したがって、本研究は生体分子の挙動と水、イオンの挙動を同時にシミュレートできる古典分子動力学法により、固液界面、更にはバイオインターフェイスのダイナミクスについての理解を目指している。現在のところ、0.5MのNaCl水溶液と(100)SiO2による固液界面モデルを作成し、分子動力学計算を行っている。そこでは、固液界面近傍とバルク溶液における水やイオンの挙動を比較検討している。
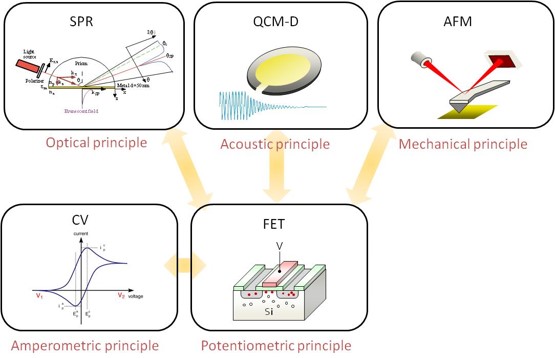
3. マルチバイオパラメータの同時計測技術
環境中の化合物の同定や疾患に関連するバイオマーカーを分析する場合、いくつかの計測装置を使用する。酸化還元反応、pH変化、抗原-抗体反応、DNAハイブリダイゼーションなど様々な化学物質の認識反応が想定される。その際、ターゲットとなる化学物質は様々な物性を有する。例えば、分子量、分子構造、電荷量、電気容量、親疎水性など、同じ分子量のものでも電荷量が異なる場合や当然分子構造も様々である。このように、研究現場や医療現場において、特定の化学物質を特異的に検出するためには、そのターゲットの特徴に合わせた計測を何通りか想定し分析する必要がある。この時、物性を一つ一つ各機器で計測していくことになるが、特定しづらいターゲットほどその手間と時間を要することになる。すなわち、複数の物性を同時に計測可能となれば、各機器を別々に準備する必要もなく測定に要する時間も一度で済ませることができ、また使用するセンサーや試薬などの消耗品も一度の使用で済むので手間とコストの削減になることは言うまでもない。また、同時計測が可能となれば、想定されていない物性値から新たなバイオマーカーなどのターゲットの特性や発見が期待される。ここでは、生体関連物質に基づくいわば「バイオパラメータ」をマルチに同時計測する技術の開発を行っている。
Competition and Cooperation – my leadership style as a researcher
坂田利弥、 TEDxUTokyo 2016, 2016/05/29



